公司资讯
Cell Reports 丨M1&M2 巨噬细胞极化的转换
发布日期:2024-09-30
Cell Reports 丨M1&M2巨噬细胞极化的转换
巨噬细胞作为先天性免疫的重要组成部分,其激活状态可随环境变化。将促炎的M1型巨噬细胞转变为抗炎的M2型,以抑制炎症性疾病,备受关注。但我们的研究发现,小鼠和人的M1巨噬细胞在IL-4作用下,在体内外均难以转化为M2型。相反,M2型巨噬细胞更具可塑性,易转变为M1型。我们确定,M1型巨噬细胞中线粒体氧化磷酸化的抑制是阻碍其向M2型转变的关键因素。抑制M1型巨噬细胞中的一氧化氮产生,可保护线粒体功能,进而促进M2型巨噬细胞的代谢和表型重塑。因此,炎性巨噬细胞激活会削弱氧化磷酸化,阻碍其向抗炎状态转变。恢复线粒体功能可能有助于将炎症巨噬细胞重新编程为抗炎细胞,以控制疾病。
实验结果:
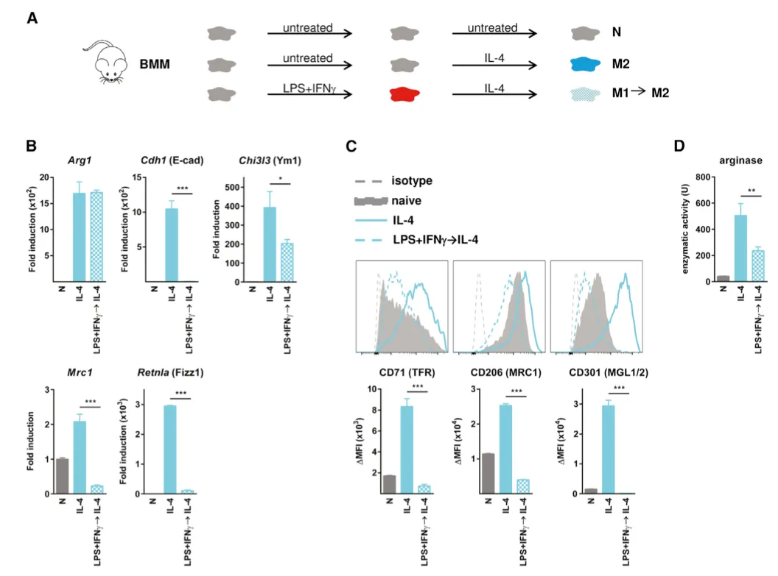
1. 小鼠 M1 巨噬细胞在体外 IL-4 再刺激后无法再极化为 M2
为了探索慢性炎症性疾病治疗中巨噬细胞的复极化潜力,作者评估了M1细胞的复极化能力。他们发现,经LPS+IFNγ预处理的小鼠骨髓源性巨噬细胞(BMM)在IL-4刺激下,未能有效上调M2特异性标记基因,且恢复时间并未改善这一状况。同时,这些预处理细胞也未表现出M2表面标记的诱导。尽管Arg1基因表达具有可塑性,但M1向M2转变的巨噬细胞在IL-4诱导下的精氨酸酶功能减弱。此外,LPS+IFNγ预处理还损害了IL-10引发的M2样表型诱导。相比之下,M2巨噬细胞在LPS+IFNγ再刺激后易重新极化为促炎状态,而M1激活则阻止了随后的M2极化,这在基因和蛋白质水平上都得到了体现。
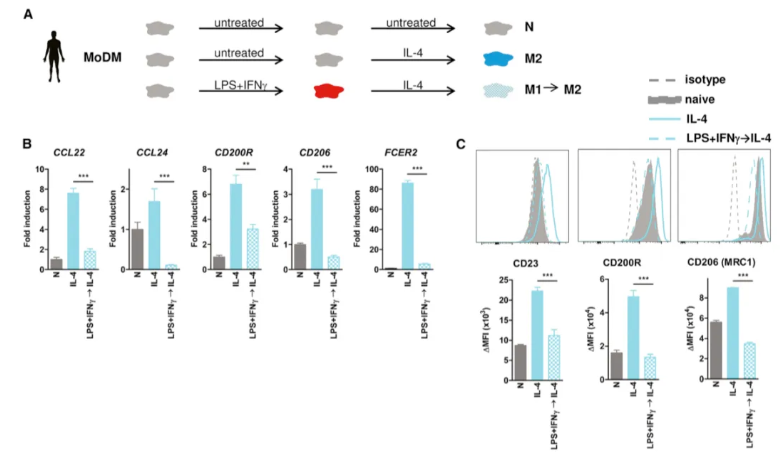
2. 人类炎性巨噬细胞不会复极化为 M2
为了验证这些发现在人类中的适用性,作者探究了外周血单核细胞衍生的人巨噬细胞(MoDM)的M1向M2复极化的能力(见图2A)。与人类小鼠巨噬细胞的研究结果一致,人类M1巨噬细胞在IL-4诱导下,M2标记基因如CCL22、CCL24、CD200R、CD206和FCER2(CD23)的表达受到严重阻碍(见图2B)。因此,在先前的LPS+IFNγ刺激后,M2表面标记CD23、CD200R和CD206并未被IL-4诱导(见图2C)。这表明,无论是小鼠还是人类巨噬细胞,在经历先前的炎症刺激后,均难以响应IL-4的诱导。
相反,人IL-4诱导的M2细胞在LPS+IFNγ处理后能够逆转为炎症状态,这通过M1标记基因和表面标记的高表达以及炎症细胞因子分泌的增加得到了证实。因此,尽管M2向M1的复极化在小鼠和人类巨噬细胞中均能有效发生,但M1向M2的转换却难以实现。
3. 炎症性巨噬细胞无法在体内复极化为 M2
为了探究体外观察到的M1向M2复极化缺陷是否在体内同样存在,作者进行了体内实验。他们将未经处理或LPS+IFNγ处理的BMMs从CD45.1+供体小鼠过继性转移到CD45.2+受体小鼠,并给予IL-4c诱导M2极化。结果显示,LPS+IFNγ处理的巨噬细胞在体内IL-4攻击后炎症细胞因子分泌和NO产生增强,且未能上调M2表面标志物。这表明,与体外观察一致,M1巨噬细胞在体内也无法转化为M2细胞。

4. LPS + IFNγ 治疗减弱小鼠巨噬细胞中的线粒体氧化呼吸
作者进一步研究了小鼠BMM中M1细胞无法重新极化为M2细胞的原因。他们首先评估了IL-4Rα表达和STAT6磷酸化,发现M1极化增强了IL-4Rα水平,且M1→M2复极化巨噬细胞显示出有效的STAT6磷酸化。然而,M1巨噬细胞的活性低于幼稚细胞,尤其是M2细胞,这表明存在代谢差异。通过细胞外通量分析,作者发现M2巨噬细胞具有增强的氧化磷酸化(OXPHOS)和糖酵解转换能力,而M1巨噬细胞则表现出糖酵解增加、OXPHOS抑制和脂肪酸氧化减少。深入研究表明,LPS+IFNγ处理完全抑制了线粒体呼吸复合物I和II的活性,并部分抑制了复合物II和IV的活性,且这种抑制无法通过随后的IL-4再刺激恢复。因此,M1巨噬细胞在表型、功能和代谢方面均无法重新极化为M2细胞。
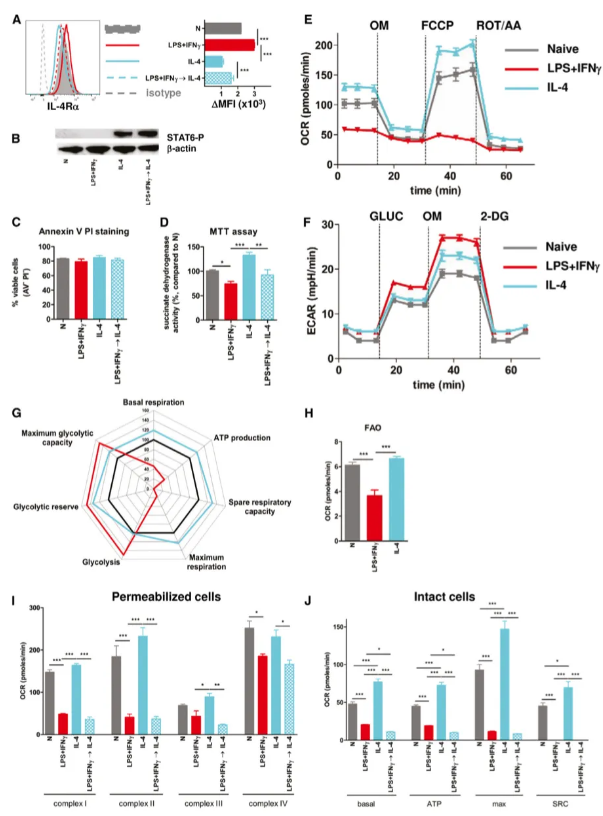
5. 线粒体功能是诱导 M2 表型所必需的
LPS+IFNγ通过抑制线粒体氧化磷酸化(OXPHOS)阻碍M1向M2巨噬细胞的复极化。实验显示,阻断线粒体ATP合酶或糖酵解会消除IL-4诱导的M2相关基因表达,表明线粒体呼吸和糖酵解对M2极化至关重要。尽管脂肪酸氧化(FAO)被LPS+IFNγ抑制,但它对M2基因诱导的影响有限。因此,LPS+IFNγ将巨噬细胞锁定在一种代谢状态,阻止了未来的IL-4诱导极化。

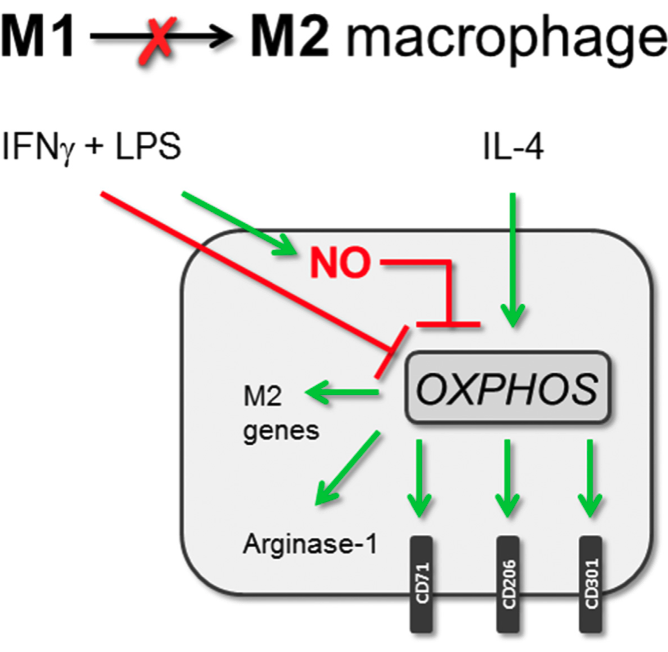
6. NO 抑制线粒体呼吸并阻止 M1 巨噬细胞的可塑性
作者探究了LPS+IFNγ诱导线粒体功能下降并阻止未来IL-4反应的机制。实验发现,iNOS抑制剂1400W能显著改善M1巨噬细胞中的线粒体功能,如基础呼吸、线粒体ATP产生和最大呼吸。在M1极化期间抑制iNOS还能促进随后的IL-4诱导的代谢重编程,增强OXPHOS,并提高电子传递链复合物活性。因此,iNOS抑制提高了M1→M2复极化能力,表现为增强的表型可塑性,如CD71、CD206和CD301表达增加。然而,iNOS抑制对M2极化本身无影响,表明NO仅阻碍M1→M2复极化,而不影响M1和M2极化。Nos2-/-巨噬细胞也显示出改善的M1→M2表型复极化,与线粒体呼吸改善相关,进一步证实了NO的作用。
更多服务咨询请致电:
15001394959
15555144551
17666664644
导科医药竭诚为您服务~